|

|
|
|
4.4 Gewinnung, Konservierung,
Beurteilung und Transfer
männlicher Gameten am
Beispiel des Rindes
|
|
|
|
Unmittelbar nach der Gewinnung des Ejakulats wird dieses unter standardisierten Bedingungen beurteilt . Das Ziel ist die Vorhersage der Befruchtungsfähigkeit. Aufgrund der Untersuchungsresultate wird entschieden, ob ein Ejakulat für die KB verwendet wird oder nicht. Das Ejakulat wird anhand quantitativer (Volumen, Dichte, Gesamtzahl) und qualitativer (Bewegung, Morphologie, Seminalplasma, Beimengungen) Parameter beurteilt. Bis zur weiteren Verarbeitung sollte das Ejakulat keinen raschen Temperaturschwankungen unterworfen werden, da sich diese auf die Qualität negativ auswirken können.
|
|
|
|
Makroskopische Beurteilung
|
|
Bei der makroskopischen Untersuchung wird das Volumen beurteilt unter Berücksichtigung von Parametern wie Alter und Rasse. Das Ejakulatvolumen wird zu 80 bis 90% durch das Seminalplasma bestimmt, welches von den akzessorischen Geschlechtsdrüsen produziert wird.
Die Tabelle „Richtwerte an Ejakulate zur Weiterverarbeitung“ zeigt für jede Spezies auf, welche Normen ein Ejakulat erfüllen sollte, um für eine Weiterverarbeitung geeignet zu sein. |
|
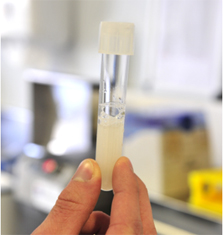
Abb. 10 - Spermabeurteilung Makro |
|
Ejakulat |
|
|
|
Abb. 10
Makroskopische Beurteilung eines Ejakulates vom Stier.
|
|
Mikroskopische Beurteilung
|
|
|
Unter dem Mikroskop wird die Anzahl der Spermien pro Raumeinheit (Spermiendichte = Spermienkonzentration) ermittelt. Verschiedene Messverfahren stehen zur Verfügung. In grösseren Betrieben wird anstelle der mikroskopischen Untersuchung meist ein Photometer oder ein Partikelzählgerät verwendet. Die Spermiengesamtzahl wird rechnerisch aus Spermiendichte und Ejakulatvolumen bzw. –gewicht bestimmt.
Einer der wichtigsten Beurteilungsschritte ist die Motilitätsbestimmung. Dazu wird ein Phasenkontrastmikroskop verwendet. Der Prozentsatz der vorwärtsbeweglichen, der ortsbeweglichen und der unbeweglichen Spermien wird bestimmt. Die Zahlen sind semiquantitative Schätzwerte, die durch erfahrenes Personal festgelegt werden. Personenunabhängig kann die Motilität durch die computergesteurte Videomikrographie ermittelt werden. Für eine weitere Verarbeitung sollte der Wert an vorwärtsbeweglichen Spermien 70% nicht unterschreiten.
In den nächsten Jahren wird sich mit grosser Wahrscheinlichkeit die Durchflusszytometrie als Standartmethode zur Beurteilung der Lebensfähigkeit der Spermien durchsetzen. Dabei wird dem Ejakulat ein Farbstoff beigesetzt, der sich in lebenden Zellen nicht anreichert, in toten jedoch schon. Das Verhältnis von intakten/toten Spermien wird im Durchflusszytometer anhand der Farbstoffanreicherung bestimmt.
Massive morphologische Veränderungen fallen auch im nicht gefärbten und unfixierten Präparat auf, wenn sie vermehrt auftreten. Weitergehende morphologische Abklärungen sollten bei allfälligen späteren Problemen und bei neuen Samenspendern gemacht werden. Dazu werden die Spermien angefärbt (Flüssigfixation nach Hancock oder Lebend-tot-Färbung mit Eosin-Nigrosin). Es gibt spezifische Färbungen z.B. für die Kopfkappen, somit können auch einzelne Spermienteile spezifisch beurteilt werden.
|
|
|
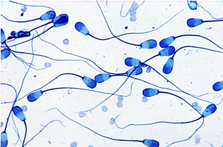
| Abb. 11 - Normale Spermien des Stieres |
|
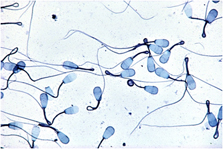
Abb. 12 - Spermienmissbildungen |
|
Legende |
 |
|
|
|
Abb. 11
Die Spermien zeigen eine einheitliche Kopfform, normale Mittelstücke und Schwänze.
Abb. 12
Ejakulat des Stieres mit Anomalien des Spermienschwanzes.
|
| Bei der mikroskopischen Untersuchung wird auch auf Fremdzellen oder Beimengungen geachtet. Fremdzellen können unter anderem Epithelzellen, Erythrozyten oder Leukozyten sein. Letztere gelten, falls sie im Ejakulat nachgewiesen werden, immer als bedenklich, und das Ejakulat sollte von der Weiterverarbeitung ausgeschlossen werden. Epithelzellen und eine geringe Zahl an Erythrozyten hingegen gelten als unbedenklich. |
|
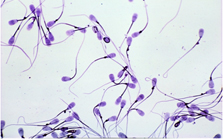
Abb. 13 - Spermienmissbildungen |
|
Legende |
|
|
|
Abb. 13
Ejakulat des Stieres mit proximalen und distalen Protoplasmatropfen.
|
|
|